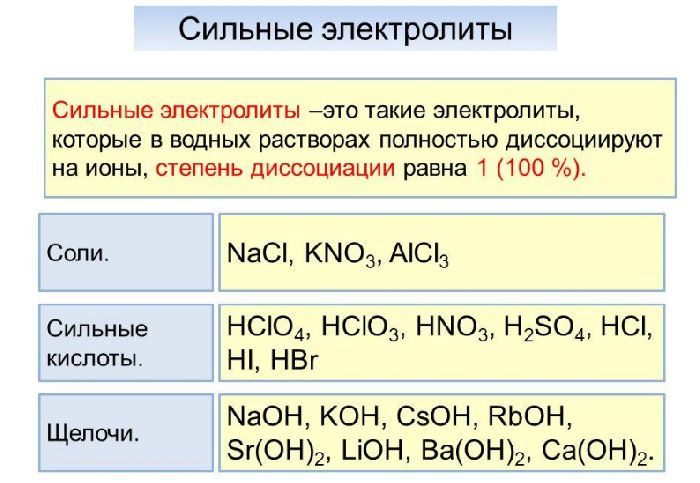
Сильные и слабые электролиты таблица, Таблица сильных и слабых электролитов

Степень диссоциации показывает, какая часть растворенных молекул вещества распалась на ионы. Соотношение является следствием закона действующих масс и равенства. Неэлектролиты — водные растворы, в которые вещество перешло в виде молекул с сохранением первоначальной структуры.
Электропроводность электролитов связана со скоростями движения ионов в растворе. Скорость движения v i [м.
Коэффициент пропорциональности u [м 2. В -1 ] называется абсолютной подвижностью иона.
Произведение u i F F - постоянная Фарадея называется подвижностью иона i [Ом Подвижность иона при бесконечном разбавлении называется предельной подвижностью иона и обозначается i 0. Предельные подвижности i 0 некоторых ионов в водном растворе [Ом Согласно закону Кольрауша о независимой миграции ионов, эквивалентная электропроводность раствора при бесконечном разведении равна сумме предельных подвижностей катионов и анионов:.
Доля тока, переносимая данным ионом, называется числом переноса t i иона:. Согласно закону Стокса , предельная подвижность 0 иона с зарядом z и радиусом r в растворителе с вязкостью h описывается формулой:.
Предельные подвижности i 0 некоторых ионов в водном растворе при 25 o C [Ом Пример Удельная электропроводность 0. Удельная электропроводность насыщенного раствора BaCO 3 в воде при 18 o C равна Удельная электропроводность воды 4. Рассчитать растворимость BaCO 3 в воде при 18 o C в моль. Рассчитать эквивалентную электропроводность раствора и кажущуюся степень диссоциации соли в растворе. Рассчитать удельную электропроводность абсолютно чистой воды при 25 o C.
Ионное произведение воды при 25 o C равно 1.

Какова удельная электропроводность бесконечно разбавленного раствора AgCl при 25 o C? Так положительно заряженные ионы называются катионами , а отрицательно заряженные — анионами.
Аррениус является автором теории электролитической диссоциации. Под этим понятием подразумевается процесс, при котором вещество распадается на отдельные ионы.

Степень диссоциации зависит от характера электролита и вычисляется по формуле:. К подобным относятся:. Начать преподавать.
Лампочка загорается только при замыкании электрической цепи, если лампочка загорелась, можно сделать вывод от том, что раствор проводит электрический ток, следовательно, вещество является электролитом. Например, при опускании электродов в раствор метанола, лампочка не загорелась, значит, метанол — неэлектролит. Если в такой же установке заменить раствор метанола на раствор соляной кислоты, то лампочка светит ярким светом.
Почему одни вещества проводят электрический ток, а другие нет? Способность веществ проводить ток определяется их способностью диссоциировать в растворах или расплавах. Только диссоциирующие вещества являются электролитами, для этого вещества должны иметь полярное строение.
Даже электролиты проводят ток неодинаково.
Например, если использовать раствор плавиковой кислоты в этом случае нельзя брать стеклянный стакан, так как плавиковая кислота растворяет стекло , то лампочка будет загораться слабым светом, поэтому следует говорить об этой кислоте, как о слабом электролите. Полный список сильных и слабых кислот в нашем материале Классификация кислот.