Гемотрансфузия при анемии, Эффективность трансфузий донорских эритроцитов у больных гемобластозами с анемией

Слишком мало исследований оценили качество жизни, чтобы мы могли увидеть, различалось ли оно между группами. Переливание крови показано только при тяжелой симптоматической послеоперационной анемии, если восполнения объема кровопотери и назначения препаратов, повышающих уровень гемоглобина, недостаточно для клинического эффекта. Однако хирургические операции могут приводить к осложнениям, связанным с серповидными клетками. Главная задача агрессивного интенсивного режима переливания - понизить количество серповидных эритроцитов в крови до определенного уровня обычно серповидные клетки удаляются и вводятся донорские клетки обменное переливание.
Нормохромная анемия — нередкая находка у пациентов, страдающих артериальной гипертензией АГ , и чаще встречается при неконтролируемой гипертензии.
Низкий уровень гемоглобина ассоциируется с плохим контролем артериального давления и является индикатором повышенного сердечно-сосудистого риска [5]. Согласно литературным данным, пациенты, страдающие АГ с сопутствующей анемией, имеют более высокие значения среднесуточного, ночного и недостаточное снижение ночного систолического артериального давления по сравнению с теми, у которых наблюдался нормальный уровень гемоглобина. У пациентов с анемией также прослеживается тенденция к увеличению среднесуточных значений диастолического артериального давления [6].
У пациентов с изолированной систолической гипертензией и гипертрофией левого желудочка с сопутствующим снижением уровня гемоглобина наблюдается увеличение сердечно-сосудистой смертности и частоты развитий острых нарушений мозгового кровообращения [7].
Электрокардиографические реполяризационные изменения депрессия сегмента ST, инверсия зубца Т, удлинение интервала QT часто встречаются у пациентов с анемией как в покое, так и при нагрузке [8]. Было обнаружено, что уровень гемоглобина сильно коррелирует с изменениями на электрокардиограмме [9].
Удлинение интервала QT является предиктором желудочковой аритмии и внезапной смерти. Гипоксия и нарушение доставки кислорода у пациентов с анемией может быть причиной нарушения реполяризации миокарда. Согласно проведенным исследованиям, анемия, макроцитоз и анизоцитоз коррелируют с удлинением интервала QT у пациентов с артериальной гипертензией и могут учитываться в оценке риска внезапной смерти [10]. Низкий уровень железа в остальном у практически здоровых детей отрицательно коррелирует с интервалами QT и QTс и может указывать на дополнительный риск развития аритмии [11].
Mehta и соавт. Эти электрофизиологические изменения исчезали после лечения препаратами железа ещё до нормализации уровня гемоглобина, что может объясняться эффектом железа на тканевом уровне [12].
Ишемия миокарда определяется степенью выраженности несоответствия потребности кардиомиоцитов в кислороде и возможностями его доставки. Определяющими факторами, влияющими на заинтересованность миокарда в кислороде, являются: частота сердечных сокращений, контрактильность миокарда и напряжение стенки сердца. Факторами, определяющими доставку кислорода к сердцу, являются содержание кислорода в крови и интенсивность коронарного кровотока.
Увеличение доставки кислорода к миокарду в ответ на увеличение потребления происходит путем уменьшения сопротивления коронарного русла. У пациентов без коронарной патологии даже значительное снижение содержания кислорода в коронарном кровотоке может компенсироваться за счёт периферической вазодилатации. При коронарном стенозе этот механизм имеет ограниченные возможности. Согласно данным литературы, у животных с анемией при остром инфаркте миокарда увеличивалась зона инфарцирования, снижалась насосная функция сердца и выживаемость.
Sabatine et al. Анемия является весомым фактором риска при ишемической болезни сердца ИБС. Пациенты с ишемической болезнью сердца и сопутствующей анемией имеют более выраженную степень коронарной патологии. Согласно ряду публикаций, у пациентов с ИБС и анемией уровень гемоглобина, сывороточного железа и общая железосвязывающая способность крови отрицательно коррелируют с тяжестью коронарной патологии [16].
У пациентов с ишемической болезнью сердца и сопутствующей анемией наблюдается увеличение смертности по сравнению с категорией лиц с изолированной ИБС, а анемия выступает независимым предиктором возникновения острого ишемического повреждения миокарда [17]. Исследование Ferreira и соавт. Он предложил включить уровень гемоглобина в оценку риска пациентов, госпитализированных с острым коронарным синдромом, так как это является доступным параметром и систематически оценивается при госпитализации [18].
В исследовании Cadilac анемия часто встречалась у пациентов, направленных на первичную ангиопластику по поводу острого инфаркта миокарда. Была продемонстрирована сильная корреляционная связь между снижением уровня гемоглобина и развитием неблагоприятных исходов, увеличением смертности.
Сделан вывод, что анемия выступала независимым предиктором госпитальной и общей смертности к концу первого года постинфарктного периода [19]. Тяжелая анемия может приводить к дисбалансу между доставкой и потреблением кислорода в миокарде даже при отсутствии гемодинамически значимого коронарного стенозирования.
Bailey с соавт. Таким образом, причины неблагоприятных исходов у пациентов с анемией и коронарной патологией многочисленны. Уменьшение кислородной емкости крови, а также активация симпатической нервной системы могут повышать потребность миокарда в кислороде и усугублять ишемию. Анемия — частое сопутствующее патологическое состояние при сердечной недостаточности СН. У пациентов с сердечной недостаточностью и сопутствующей анемией прослеживается следующая тенденция: у них более выражены симптомы левожелудочковой недостаточности, выше частота госпитализаций по поводу декомпенсации хронической сердечной недостаточности ХСН , среди них чаще встречаются женщины, пациенты представлены старшей возрастной группой, у них чаще диагностируется сахарный диабет, сопутствующая почечная недостаточность и артериальная гипертензия [21].
Анемия — мощный предиктор повторных госпитализаций и низкой выживаемости при хронической сердечной недостаточности [22]. Частота встречаемости анемии возрастает при увеличении степени тяжести сердечной недостаточности и может достигать Этиология анемии при сердечной недостаточности является многофакторной, и множество механизмов ответственно за это состояние.
Увеличение системного воспаления, нейрогуморальная активация, нарушение питания, дисфункция почек, снижение ответа костного мозга на запрос и эффект приема ряда лекарственных средств вносят вклад в ее развитие.
Увеличение циркулирующих провоспалительных цитокинов при СН вызывает нарушение мобилизации железа, недостаточную продукцию эритропоэтина в ответ на активацию ренин-ангиотензин-альдостероновой системы и снижение почечного кровотока, снижение функции костного мозга.
Использование ингибиторов ангиотензин-превращающего фермента может дополнительно уменьшать секрецию эритропоэтина. Нарушение питания вследствие отсутствия аппетита, желудочно-кишечная мальабсорбция, прием аспирина могут усугублять железодефицитную анемию. Гемоделюция также вносит дополнительный вклад в становление анемии [24]. Дефицит железа ДЖ — наиболее частая причина анемии у пациентов с сердечной недостаточностью [25,26]. ДЖ может быть представлен в абсолютной и функциональной формах.
При абсолютном дефиците железа наступает истощение его запасов в организме, а железодефицитная анемия может рассматриваться как конечная стадия этого истощения. Функциональный дефицит железа связан с неадекватным его высвобождением из депо в ответ на потребности костного мозга и встречается при многих острых и хронических воспалительных состояниях. Дефицит железа ассоциируется с прогрессированием симптомов сердечной недостаточности, снижением качества жизни, увеличением смертности и госпитализаций [].
Активация симпатической и ренин-ангиотензин-альдостероновой систем, хроническое воспаление, абсолютный и функциональный дефицит железа, нарушение образования и активности эритропоэтина, гемоделюция, почечная дисфункция ухудшают прогноз у пациентов с сердечной недостаточностью.
Вероятно, анемия является как медиатором, так и маркером неблагоприятного прогноза у пациентов с сердечной недостаточностью. Лечение анемии при сердечной недостаточности и ишемической болезни сердца может включать прием эритропоэтинов, при наличии железодефицитных состояний с анемией или без нее - терапию препаратами железа, при тяжелом течении - переливание эритроцитарной массы.
Шестнадцать рандомизированных контролируемых исследований оценивало эффект эритропоэтинов у пациентов с сердечной недостаточностью.
Большинство этих исследований включало пациентов с систолической сердечной недостаточностью. Полученные данные с умеренной степенью доказательности продемонстрировали отсутствие улучшения качества жизни и переносимости физических нагрузок при лечении эритропоэтинами. В то же время данные с высокой степенью доказательности продемонстрировали отсутствие снижения смертности при лечении эритропоэтинами.
Среди серьезных побочных эффектов, связанных с их применением, выделили развитие сосудистых тромбозов [31]. Несмотря на то, что анемия часто встречается у пациентов с хронической сердечной недостаточностью и ишемической болезнью сердца, лечение эритропоэтинами не уменьшало смертность, риск кардиоваскулярных событий или частоту госпитализаций [31].
Американский Колледж Врачей не рекомендует использование эритропоэтинов у пациентов с сердечной недостаточностью или коронарной болезнью сердца при незначительной или умеренной степени тяжести анемии [31].
Переливание крови было предложено для коррекции тяжелой анемии у пациентов с коронарной болезнью сердца, но результаты ее эффективности противоречивы. Большинство данных получено при использовании либеральных или рестриктивных протоколов гемотрансфузий. Метаанализ 10 исследований, включавший , пациентов с острым коронарным синдромом выявил, что либеральная гемотрансфузия ассоциировалась с увеличением общей смертности по сравнению с рестриктивной гемотрансфузией или ведением пациентов без нее [32].
На сегодняшний день нет единого мнения в отношении либеральной и рестриктивной гемотрансфузионной тактики у пациентов с ИБС.
Ряд исследований с низкой степенью доказательности показывают, что ограничительная трансфузия не оказывает эффект на смертность у пациентов с коронарной патологией сердца по сравнению с либеральной трансфузией. Из-за противоречивых результатов исследований и недостатка полноценных рандомизированных контролируемых исследований рестриктивная гемотрансфузия может иметь место в условиях острого коронарного синдрома и у госпитализированных пациентов с коронарной болезнью сердца [31, 34].
Положительные эффекты лечения внутривенными препаратами железа при дефиците железа с анемией или без у пациентов с сердечной недостаточностью.
Железо является жизненно необходимым элементом для организации целого ряда жизненно важных функций в организме. Оно служит переносчиком кислорода к клеткам, является частью важных ферментных систем в различных тканях. Железосодержащие ферменты выполняют функцию по переносу электронов внутри клетки, а их функция в окислительном метаболизме — перенос энергии внутри митохондрии.
Другой ключевой функцией железосодержащих ферментов например, цитохром Р является синтез стероидных гормонов и желчных кислот; обезвреживание токсинов в печени; контроль эффекта нейротрансмиттеров, таких как допамин, и серотониновых систем головного мозга [35].
Несколько исследований были адресованы лечению пациентов с заболеваниями сердца внутривенными препаратами железа. Внутривенное назначение карбоксимальтозы железа увеличивало переносимость и продолжительность физических нагрузок у пациентов со стабильной сердечной недостаточностью и хроническим заболеванием почек ХБП , не выше 3 стадии ХБП.
Это исследование показало, что назначение мг препарата карбоксимальтозы железа внутривенно увеличивало дистанцию теста 6-минутной ходьбы м против м по сравнению с внутривенным назначением физиологического раствора [36].
Данное исследование с умеренной степенью доказанности продемонстрировало, что внутривенный препарат железа улучшал качество жизни у пациентов с анемией или дефицитом железа со стабильным течением ХСН и хроническим заболеванием почек не выше 3 стадии.
Fair-HF исследование показало, что лечение внутривенным препаратом железа улучшало функциональный класс сердечной недостаточности и показатели качества жизни независимо от того, присутствовали в пациента лабораторные признаки анемии или нет [36]. Это исследование также продемонстрировало отсутствие статистически значимой разницы в частоте существенных побочных эффектов между пациентами, принимавшими внутривенно карбосимальтозу железа, и контрольной группой [36].
Целью CONFIRM-HF исследования было изучение долгосрочного эффекта от лечения препаратом карбоксимальтозой железа у пациентов с симптоматической сердечной недостаточностью и дефицитом железа. В результате исследования было выявлено, что лечение стабильных симптоматических пациентов с сердечной недостаточностью и дефицитом железа внутривенным препаратом карбоксимальтозой железа приводит к устойчивому улучшению их функционального состояния согласно тесту 6-минутной ходьбы; улучшению качества жизни; значительному уменьшению риска госпитализаций вследствие прогрессирования сердечной недостаточности.
Наблюдения за пациентами осуществлялось в течение одного года. Вышеперечисленные положительные эффекты были отмечены во всех подгруппах, включая пациентов с анемией или без нее [37]. Результаты CONFIRM-HF исследования по сравнению с Fair-HF имели более объективные первичную и конечную точки, показали более продолжительный положительный эффект от лечения карбоксимальтозой железа с хорошим профилем безопасности и продемонстрировали значительное снижение риска госпитализации вследствие ухудшения сердечной недостаточности [37].
Метаанализ всех рандомезированных контролируемых исследований, изучавших эффект лечения внутривенными препаратами железа у пациентов с систолической сердечной недостаточностью и дефицитом железа, показал, что ее применение у данной категории пациентов уменьшает риск комбинированных конечных точек: общей смертности и сердечно-сосудистых госпитализаций, сердечно-сосудистой смертности и госпитализации по поводу ухудшения сердечной недостаточности, и риск госпитализаций по причине декомпенсации ХСН.
Не было выявлено значимого эффекта на общую и на смертность от сердечно-сосудистых причин. Вместе с тем, внутривенная терапия препаратами железа приводила к улучшению переносимости физических нагрузок, уменьшению симптомов сердечной недостаточности и улучшению качества жизни пациентов [38].
Внутривенное назначение препарата карбоксимальтозы железа должно рассматриваться в качестве лечения у симптомных пациентов с систолической сердечной недостаточностью и дефицитом железа для уменьшения клинических проявлений, повышения толерантности к физическим нагрузкам и улучшения качества жизни [39]. Лечение анемии у пациентов с заболеваниями сердца может существенно отличаться от лечения анемии в общей популяции. Однако понимание доказательной базы и использование клинического суждения крайне необходимы для лечения данной категории лиц.
Анемия коррелирует с ухудшением прогнозов у пациентов с кардиоваскулярной патологией и становится новой терапевтической мишенью для данной категории пациентов.
Вопрос, является ли анемия причиной или маркером неблагоприятных исходов и отражает лишь тяжесть сердечно - сосудистого заболевания, остается актуальным по сей день. Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, способного повлиять на результаты исследования или их трактовку. Cardiovascular disease is a significant health problem around the world and accounts for the majority of deaths annually.
Many of such patients have anemia due to acute blood loss surgery or trauma or chronic conditions such as renal failure or cancer. It is a major health problem that increases the mortality rate, affects physical status, and demands referral to health-care professionals. Globally, anemia affects 1. The highest prevalence is in preschool-age children Half of the cases are due to iron deficiency [1] which affects not only red blood cell production but also cellular functions related to muscle metabolism, mitochondrial function, neurotransmitters, DNA synthesis, and the immune system [2].
Prevalence of anemia increases with the advanced age making it a common associated comorbidity in patients with cardiovascular diseases. It has been established that anemia is an independent risk factor for cardiovascular diseases CVD outcomes [3]. Effects of anemia on the cardiovascular system. Understanding the physiologic response to anemia is important in order to take into account the implications of this state in regards to cardiac diseases.
Three main factors are responsible for oxygen delivery to organs: blood flow and its distribution; the oxygen-carrying capacity of the blood, i. Hypoxia in anemia is compensated through several non-hemodynamic increased erythropoietin production to stimulate erythropoiesis, increased oxygen extraction and hemodynamic mechanisms.
The main hemodynamic factors are decreased afterload, increased preload, and positive inotropic and chronotropic effects. Enhanced nitric oxide activity, hypoxia-induced vasodilatation and lower blood viscosity are responsible for reduced vascular resistance and lead to the decreased afterload. Chronic anemia stimulates angiogenesis and recruitment of new microvessels.
Enhanced venous return preload and left ventricular LV filling lead to the increased LV end-diastolic volume and cardiac output. Increased cardiac output is responsible for arterial remodeling of the central elastic arteries such as the aorta and common carotid artery through arterial enlargement and compensatory arterial intima-media thickening, leading to the elevated systolic pressure and high inertia due to higher blood mass in the dilated arterial system. Activation of sympathetic activity enhances LV contractility, and the heart rate.
Short-lasting anemia is reversible but in chronic anemia hemodynamic changes lead to cardiac enlargement and development of eccentric LV hypertrophy LVH. It also occurs in other forms of the volume overload.
In case of heart diseases chronic anemia contributes to a high incidence of cardiovascular complications [4]. Normocytic anemia is common in hypertensive patients but more prevalent in uncontrolled hypertension.
Lower hemoglobin is associated with poor blood pressure control, indicating a higher cardiovascular risk in uncontrolled hypertension [5]. It was noted that hypertensive patients with anemia had higher nocturnal systolic and mean blood pressure and a lower dipping status compared to the patients with normal hemoglobin levels.
There was a trend for increased diastolic blood pressure [6]. In patients with isolated systolic hypertension and left ventricular hypertrophy lower hemoglobin was associated with the increased cardiovascular death or stroke [7].
Electrocardiographic ECG repolarization abnormalities ST segment depression, T wave inversion, prolonged QT are highly prevalent in anemic patients at rest and during the tests with physical loading [8]. It has been shown that the hemoglobin level is strongly correlated with ECG changes [9].
Hypoxia and impaired oxygen supply in anemic patients may affect repolarization of the myocardium. It has been found that anemia, macrocytosis and anisocytosis are associated with prolonged QT intervals in hypertensive patients and may contribute to the risk of sudden cardiac death [10].
Low iron stores in otherwise healthy children negatively correlated with QT and QTc intervals and may indicate some risk in developing arrhythmias [11].
Mehta et al. These electrophysiological changes were corrected after iron therapy, even before the rise of hemoglobin occurred, which may be explained by the effect of iron on the tissue level [12]. Myocardial ischemia is defined as oxygen delivery that is insufficient to meet oxygen requirements. The determinants of myocardial oxygen demand are wall tension, heart rate and contractility. The determinants of myocardial oxygen delivery are arterial oxygen content and coronary arterial blood flow.
Patients without coronary artery disease, therefore, have a tremendous ability to compensate the decrease in coronary arterial oxygen content through distal vasodilatation but in the presence of coronary stenosis this compensatory mechanism has a limited ability. It was proved that anemic animals have the increased infarct size, decreased cardiac function and the survival rate in case of acute myocardial infarction MI. Anemia is a risk factor for ischemic heart disease.
Patients with ischemic heard disease IHD and anemia have a more advanced degree of ischemic heart disease compared to patients with isolated IHD. In anemic patients with IHD the level of hemoglobin, serum iron and total iron-binding capacity negatively correlated with the severity of IHD [16]. Anemia was an independent predictor of acute coronary syndrome based on the hemoglobin level, while both anemia and a high hematocrit level were predictors of myocardial infarction based on hematocrit [17].
The investigations made by Ferreira et al. He suggested including the hemoglobin level in risk stratification scores of patients admitted for ACS, given that it is an easy parameter to measure and is systematically assessed at admission [18]. In the Cadilac trial anemia was common in patients with AMI who underwent primary PCI and was strongly associated with the adverse outcomes and increased mortality [19].
Anemia was an independent predictor of in-hospital mortality by the end of the first year [19]. Severe anemia can lead to disbalance between oxygen delivery and demand in the myocardium even in patients without coronary stenosis.
Bailey D et al. Thus, there are a number of reasons for the worse outcomes in anemic patients with the obstructive coronary artery disease. Diminished oxygen-carrying capacity, activation of the sympathetic nervous system can increase myocardial oxygen demand and worsen ischemia. Anemia is a very common comorbidity in chronic heart failure.
Anemic patients are elderly women with more advanced symptoms and signs of heart failure, greater functional impairment and a higher hospitalization rate; they have a history of diabetes mellitus, renal insufficiency, and hypertension [21]. Anemia is a powerful predictor of rehospitalization rates and survival in case of chronic heart failure [22]. The prevalence of anemia increases with the severity of heart failure HF and can reach Etiology of anemia in HF may be multifactorial and a number of potential mechanisms may be responsible for such a condition in heart failure.
Neurohormonal and inflammatory activation, renal dysfunction, bone marrow hyporesponsiveness, malnutrition, drug effects contribute to its development. Increased circulating proinflammatory cytokines enable defective iron mobilization, inappropriate erythropoietin production, depressed bone marrow function. Activation of the renin-angiotensin-aldosteron system, decreased renal perfusion caused by the low blood pressure and stroke volume stimulate the release of erythropoietin but the response is blunted due to effect of the circulatory cytokines.
Poor nutrition due to anorexia, gastrointestinal malabsorbtion and aspirin use may precipitate iron deficiency anemia. Hemodilution can contribute to anemia. The use of the angiotensin-converting enzyme ACE inhibitor therapy may reduce secretion of erythropoietin [24]. Iron deficiency may exist in absolute or functional forms.
Absolute iron deficiency occurs when total body iron stores become exhausted and ID anemia can be considered as the final phase of iron stores depletion; functional iron deficiency refers to inadequate iron release in response to the demands of the bone marrow.
Functional iron deficiency can be seen in many acute and chronic inflammatory states. ID is associated with the worsening of symptoms in patients with heart failure, impaired life quality, the increased mortality and hospitalization level [28, 29, 30]. Activation of sympathetic and renin-angiotensin-aldosteron systems, chronic inflammation, absolute and functional iron deficiency, impaired production and activity of erythropoietin, hemodilution, renal dysfunction impair prognosis in heart failure patients.
Probably, anemia acts as a mediator and a marker of a poor prognosis in HF patients. Treatment of anemia in patients with heart diseases. Anemia treatment strategies in heart failure and CHD patients include erythropoiesis-stimulating agents ESAs , red blood cell transfusions and iron replacement in iron deficient patients with or without anemia.
Sixteen randomized, controlled trials assessed the impact of ESAs in patients with heart disease. Most of these studies included patients with CHF and the reduced systolic function.
Overall, moderate-quality evidence showed no benefit from ESAs in regard to improving exercise tolerance and duration or quality of life, and high-quality evidence showed no mortality benefit [31]. Serious harmful effects associated with the treatment include mortality and vascular thrombosis [31].
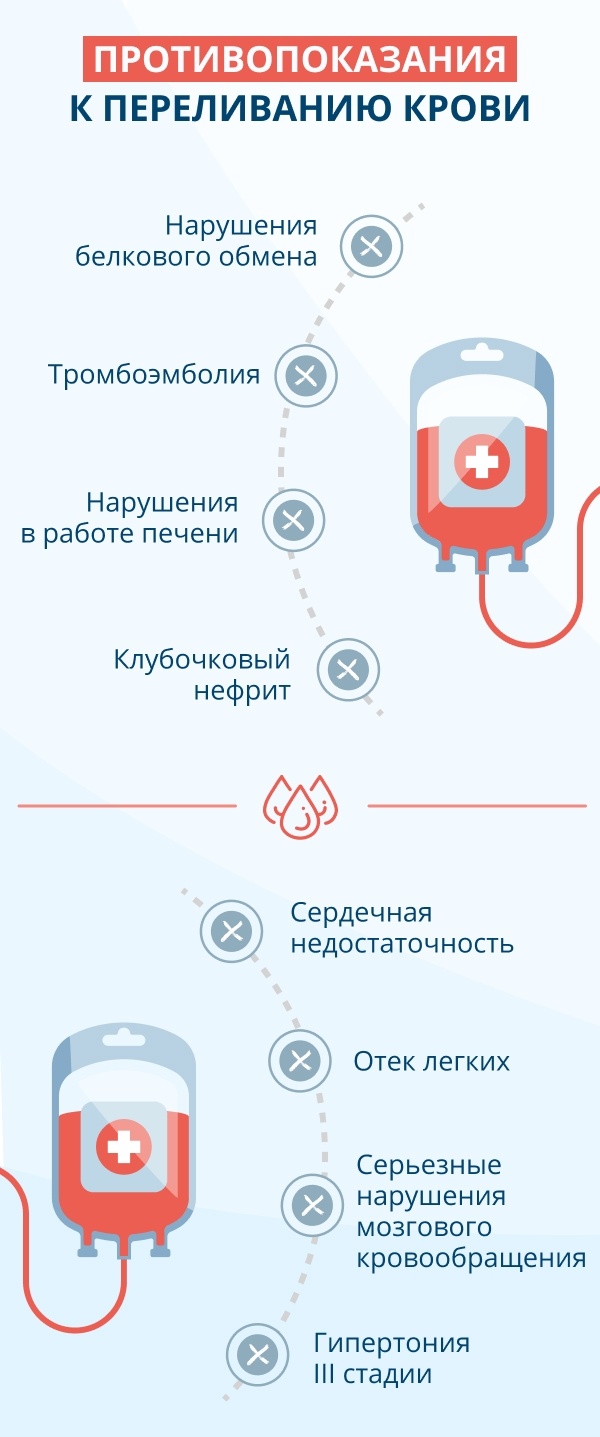
So, the damage outweighs the benefits in treatment of patients with mild to moderate anemia using ESAs. Записаться онлайн Заказать звонок. Преимущества «СМ-Клиника» в отношении гемотрансфузий крови. Принцип действия Кровь человека состоит из плазмы и различных типов клеток эритроцитов, тромбоцитов, лейкоцитов. Показания и противопоказания к гемотрансфузии По сути, переливание крови — операция, к которой разработаны строгие показания. Необходимость гемотрансфузий в любой клинической ситуации определяет врач-гематолог после тщательного обследования пациента и исключения противопоказаний, которыми являются: тяжелая сердечная недостаточность; неконтролируемая артериальная гипертензия; тяжелые нарушения функции печени, почек; острая стадия ОНМК; тяжелые аллергические реакции в анамнезе; активная фаза аутоиммунных заболеваний острый гломерулонефрит, геморрагический васкулит.
Подготовка к гемотрансфузии Несмотря на кажущуюся простоту, процедура требует тщательной подготовки, которая включает ряд обследований: клинический анализ крови; биохимический анализ крови определение печеночных, почечных ферментов, иммунологических показателей, ДНК некоторых вирусов и бактерий ; общий анализ мочи; ЭКГ; консультацию специалистов узкого профиля для уточнения соматического диагноза; консультацию трансфузиолога.
Как проходит переливание крови. Длительность процедуры 30 минут - 4 часа зависит от компонентов крови. Время пребывания в клинике часов. Максимальный объем трансфузии: мл плазмы или компонентов крови. Запись на консультацию врача. Прием осмотр, консультация врача-трансфузиолога первичный.
Размещенный прайс не является офертой. Медицинские услуги оказываются на основании договора. Выберите специалиста в удобной для вас клинике:. Каждый день о вас заботится Взрослые врачи.
Водный стадион. Новые Черёмушки. Петровский парк. Все врачи. Записаться на консультацию специалиста. Отправить заявку. Нажимая на кнопку, вы даете согласие на обработку своих персональных данных. Запись через сайт является предварительной. Наш сотрудник свяжется с Вами для подтверждения записи к специалисту. Мы гарантируем неразглашение персональных данных и отсутствие рекламных рассылок по указанному вами телефону. Ваши данные необходимы для обеспечения обратной связи и организации записи к специалисту клиники.
Мы осуществляем деятельность на основании медицинских лицензий в соответствии с рекомендациями Минздрава Посмотреть лицензии Правовая информация. Обратный звонок. Спасибо за оставленную заявку. Мы свяжемся с вами в ближайшее время. Заявки, поступившие после , будут обработаны на следующий день после Запись к врачу. Наш оператор свяжется с вами с до Заявки, поступившие после , будут обработаны на следующий день. Вы действительно хотите прервать запись? Время приема Взрослый Ребенок до 18 лет.
Ваша заявка отправлена. Вызов врача через сайт является предварительным. Наш сотрудник свяжется с Вами для подтверждения вызова специалиста. Мы используем cookie.